CONTROLLO DELLA CONTAMINAZIONE DA ENDOTOSINE SUI GUANTI STERILI PER CAMERE BIANCHE

I prodotti farmaceutici iniettabili o i dispositivi medici impiantabili contaminati da endotossine possono causare reazioni molto gravi nel paziente.
La contaminazione da endotossine di lotti di soluzioni iniettabili o di impianti può anche avere conseguenze finanziarie significative per il produttore.
Pertanto, il monitoraggio della contaminazione da endotossine sui guanti sterili in nitrile e sui guanti in lattice per camere bianche è una preoccupazione fondamentale per gli ambienti critici, compreso il settore dei dispositivi medici impiantabili e l'industria farmaceutica.
Cosa sono le endotossine batteriche e il loro impatto?
Cosa sono le endotossine batteriche?
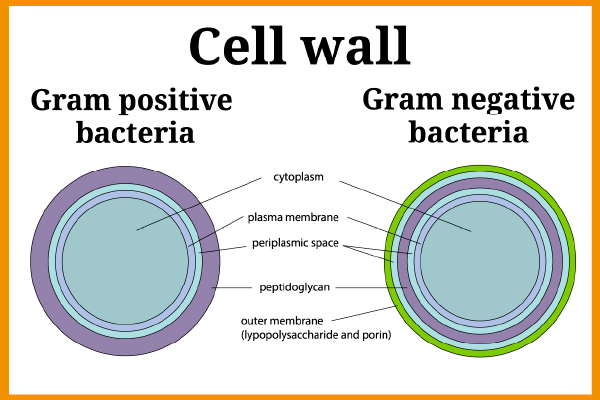
Le endotossine o lipopolisaccaridi (LPS) sono frammenti della membrana esterna dei batteri Gram-negativi (usando la tecnica della colorazione Gram, i batteri Gram-negativi producono una macchia rosa mentre è viola per i batteri Gram-positivi). Alcuni esempi di batteri Gram-negativi sono E. coli, Salmonella, Legionella, Neisseria ecc.
Figura 1 – Parete cellulare di batteri Gram positivi e Gram negativi
I batteri Gram-negativi esistono ovunque nell’ambiente (nell’acqua, negli impianti di riscaldamento, nel tratto digestivo, nelle feci…) e quindi la presenza di endotossine può rappresentare un rischio molto elevato. Le molecole di endotossina vengono rilasciate durante la lisi (distruzione della membrana di una cellula sotto l'azione di agenti fisici, chimici o biologici).
Quali sono le conseguenze della contaminazione da endotossine?
La composizione biologica delle endotossine influisce sul sistema immunitario umano e animale e può causare una reazione allergica. Di conseguenza, possono portare a reazioni infiammatorie relativamente forti. Possono anche portare a infezioni gravi in pazienti indeboliti (immunocompromessi), giovani (neonati prematuri) o anziani.
La reazione più comune è la febbre. Questo è il motivo per cui le endotossine Gram-negative sono considerate “pirogeni” , cioè molecole che provocano un aumento della temperatura corporea attivando il sistema immunitario.
Le endotossine, se inalate, possono anche causare la sindrome da distress respiratorio acuto (ARDS). Entrando nel corpo dopo un'iniezione, le endotossine possono causare coagulazione intravascolare disseminata o addirittura shock settico quando un gran numero raggiunge il flusso sanguigno.
In ambienti critici come quello dell’industria farmaceutica, il monitoraggio delle endotossine è essenziale. Ciò è particolarmente vero nella produzione di acqua di grado farmaceutico (acqua purificata), oltre che nella produzione di farmaci parenterali e iniettabili (fluidi per infusione, liquidi per dialisi...) e dispositivi medici impiantabili.
Ridurre i livelli di endotossine sui guanti per camere bianche
È noto che le endotossine sono la fonte più comune di pirogeni nei prodotti farmaceutici e nei dispositivi medici.
Le endotossine sono residui di membrana di batteri Gram-negativi. Questi ultimi sono vitali e numerosi nell’ambiente. Inoltre, le endotossine sono altamente resistenti ai processi di disinfezione o sterilizzazione, compresa l'irradiazione gamma.
Questo è il motivo per cui la carica batterica dei guanti in nitrile e in lattice dovrebbe essere limitata il più possibile prima della sterilizzazione.
La carica batterica è la concentrazione di tutti i tipi di microrganismi vitali su una superficie o in un dispositivo. La carica batterica proviene principalmente da:
- Materie prime utilizzate durante il processo produttivo (compresa l'acqua di grado farmaceutico).
- Operatori coinvolti nel processo produttivo.
- Operazioni di pulizia e confezionamento dei manufatti.
Il rilevamento e la quantificazione della contaminazione microbica sui guanti sterili SHIELD Scientific vengono eseguiti da un'organizzazione esterna e in conformità alla norma ISO 11737-1. È una parte fondamentale del processo di controllo qualità di SHIELD Scientific .
Pertanto, tutte le materie prime, gli imballaggi o i dispositivi di protezione utilizzati nella produzione di prodotti farmaceutici o dispositivi medici impiantabili devono soddisfare i requisiti sanitari non solo per quanto riguarda la sterilità ma anche la pirogenicità.
Sterilità: per garantire un livello di garanzia di sterilità (SAL) pari a 10-6 (in conformità con i requisiti della Farmacopea Europea) i guanti devono essere sottoposti a validazione microbiologica in conformità alla norma ISO 11137-2:2015 (Sterilizzazione di prodotti sanitari – Radiazioni – Parte 2: Determinazione della dose di sterilizzazione).
Figura 2 – Busta in PE dei guanti sterili SHIELDskin XTREME™ con indicatore di sterilizzazione
Apirogenicità: la depirogenazione può essere eseguita in molti modi:
- Lavaggio con acqua per preparazioni iniettabili (WFI) o altra acqua di alta qualità come acqua deionizzata.
- Trattamento termico a secco mediante esposizione ad alte temperature.
- Trattamento termico umido mediante combinazione di pressione e perossido di idrogeno (Attenzione: un'autoclave non distrugge le endotossine).
- Ultrafiltrazione delle endotossine in base al loro peso molecolare.
- Distruzione tramite ossido di etilene.
Perché è importante controllare i livelli di endotossine sui guanti sterili per camere bianche?
I requisiti di sterilità (assenza di microrganismi viventi) e pirogenicità (assenza di molecole pirogene come le endotossine) sono fondamentali per molti produttori di prodotti farmaceutici e dispositivi medici impiantabili.
Per limitare il più possibile i rischi legati alle endotossine, la contaminazione dovrebbe quindi essere controllata in tutti i processi produttivi , dalle materie prime ai prodotti finiti, compresi i dispositivi di protezione degli operatori delle camere bianche.
, infatti, può essere a diretto contatto con soluzioni iniettabili o loro contenitori e dispositivi medici impiantabili. I guanti sono quindi potenzialmente fonte di contaminazione.
Figura 3 – Sostituzione dell'ago della macchina riempitrice da parte di un operatore che indossa un doppio paio di guanti sterili SHIELD Scientific
I guanti monouso standard in nitrile e lattice subiscono un trattamento minimo una volta completate le fasi di immersione e asciugatura. Il livello di pulizia dei guanti potrebbe quindi non essere accettabile per le applicazioni in camera bianca. Da notare anche che i guanti possono essere fortemente carichi di batteri Gram-negativi. Anche i guanti sterili per camera bianca, che in genere vengono clorurati e lavati in acqua purificata, spesso non hanno garanzie in termini di livelli di endotossine.
Inoltre, poiché le particelle possono trasmettere endotossine, la scelta di guanti con un “basso livello garantito” di particelle potrebbe contribuire a rafforzare la strategia di controllo della contaminazione.
Pertanto, selezionare guanti che abbiano un basso contenuto di endotossine (<20 EU/paio come definito nella norma EN 455-3:2015) e, ancora meglio, che siano testati in batch per le endotossine può essere una soluzione.
Come viene monitorato il livello di endotossine nei guanti sterili per camere bianche?
Quadro normativo relativo alla contaminazione da endotossine dei guanti sterili
L'allegato 1 delle GMP dell'Unione Europea è uno dei principali documenti che regolano la produzione e il controllo dei medicinali. Questo documento fornisce le linee guida per la gestione del rischio di qualità. In particolare, l'Allegato I delle nuove GMP specifica che deve essere evitata la contaminazione microbica, particellare ed endotossina/pirogena dei prodotti finali. I guanti sterili per camera bianca devono quindi essere integrati nella gestione del rischio di qualità (QRM).
La norma EN 455-3:2015 (Guanti medicali monouso – Parte 3: Requisiti e test per la valutazione biologica) richiede ai produttori di guanti monouso sterili di controllare la contaminazione dei guanti da endotossine. I metodi di prova devono essere conformi ai requisiti della Farmacopea Europea, Monografia 2.6.14.
Il granchio a ferro di cavallo per rilevare le endotossine
Il metodo più utilizzato e riconosciuto per misurare il livello di endotossine batteriche sui guanti sterili per camere bianche è quello che utilizza il lisato di amebocita di Limulus (LAL).
Il granchio a ferro di cavallo è un artropodo marino ancestrale che ha la particolarità di avere il sangue blu (o meglio emolinfa nel caso di un invertebrato).
Figura 4 – Granchio a ferro di cavallo-Limulus polyphemus
Questa emolinfa contiene cellule di amebociti di forma ovoidale, che perdono questa forma e si aggregano in un coagulo in presenza di endotossine. Questa coagulazione del sangue del granchio a ferro di cavallo costituisce la base per i vari metodi di test per la determinazione delle endotossine.
Metodi di prova per la determinazione della contaminazione da endotossine nei guanti sterili
La superficie esterna di un paio di guanti viene prima sottoposta ad un'estrazione di 40-50 ml di acqua priva di endotossine (acqua LAL secondo la Farmacopea Europea) per 40-60 minuti ad una temperatura compresa tra 37°C e 40°C L'estratto viene poi, se necessario, centrifugato (2.000 g per 15 minuti) per rimuovere le particelle. Viene poi decantato prima di essere immediatamente sottoposto al test delle endotossine.
Esistono 3 principali metodi di test delle endotossine batteriche utilizzando il lisato di amebociti di Limulus:
- Test del gel-coagulo (test “qualitativo” = può rilevare la presenza di endotossine ma senza poterne determinare con precisione la quantità): formazione di un gel (“coagulo”) dopo aver miscelato l'estratto e l'agente LAL.
- Test di turbidimetria cinetica (Un test “quantitativo” = consente di rilevare la presenza di endotossine e determinarne la quantità): sviluppo di torbidità dopo la miscelazione con il reagente LAL.
- Test cromogenico (Test “quantitativo” = permette di rilevare la presenza di endotossine e determinarne la quantità): sviluppo di un colore dopo la miscelazione con il reagente LAL.
Il risultato del test è riportato in Unità di Endotossina (UE) per paio di guanti.
La norma EN 455-3:2015 afferma che per essere etichettati come “a basso contenuto di endotossine”, i guanti devono avere un limite di contenuto di endotossine pari a 20 EU per paio di guanti.
Guanti sterili SHIELD Scientific a basso contenuto di endotossine per ambienti critici
Per limitare il rischio di alcune complicanze nei pazienti, è necessario fare attenzione a utilizzare guanti sterili di buona qualità con un basso contenuto di endotossine.
Nell'ambito di una strategia generale di controllo della contaminazione e di gestione del rischio di qualità (QRM), potrebbe essere utile pensare alla selezione dei guanti e al modo in cui ciò si applica al proprio ambiente critico.
Ecco perché SHIELD Scientific ha sviluppato una gamma di guanti per camere bianche in nitrile e lattice che offrono diversi livelli di pulizia direttamente correlati alla quantità di lavaggio nell'acqua deionizzata. Per questa gamma di guanti monouso esiste una semplice classificazione:
DI: Guanti lavati singolarmente in acqua deionizzata per il controllo della contaminazione di base e una specifica del livello di particelle < 3.000 per cm² > 0,5 μm.
DI+ : guanti lavati tre volte in acqua deionizzata per un elevato controllo della contaminazione e una specifica del livello di particelle < 1.200 per cm² > 0,5 μm.
DI++ : Guanti multilavaggio in acqua deionizzata per un controllo estremo della contaminazione e una specifica del livello di particelle < 850 per cm² > 0,5μm.
Tutti i guanti sterili del marchio SHIELDskin XTREME™ sono progettati per soddisfare gli standard di qualità richiesti dagli operatori che lavorano secondo GMP al fine di ridurre il rischio di contaminazione. Tutti SHIELD Scientific sono testati in lotti per dimostrare un basso contenuto di endotossine < 20 UE (unità endotossina) per paio di guanti e un livello di garanzia di sterilità (SAL) di 10-6 (mediante sterilizzazione con irradiazione gamma).
Un certificato di irradiazione (CoI) viene fornito con ogni lotto di guanti sterili in nitrile e lattice SHIELD Scientific per camere bianche. Un certificato di conformità (CoC) fornisce dati specifici per lotto sui livelli di particelle ed endotossine.
POICHÉ IL CONTROLLO DELLA CONTAMINAZIONE DA ENDOTOSINE È VITALE IN AMBIENTI CRITICI, NON ASPETTARE OLTRE PER ORDINARE CAMPIONI O CHIEDERE CONSIGLIO A UN RAPPRESENTANTE VENDITE SHIELD Scientific .
Condividi queste informazioni interessanti