KONTROLA ZANIECZYSZCZENIA ENDOTOKSYNAMI STERYLNYCH RĘKAWIC DO POMIESZCZEŃ CZYSTYCH

Leki do wstrzykiwania lub wszczepialne wyroby medyczne zanieczyszczone endotoksynami mogą powodować bardzo poważną reakcję pacjenta.
Zanieczyszczenie endotoksynami partii roztworów do wstrzykiwań lub implantów może mieć również znaczące konsekwencje finansowe dla producenta.
Dlatego monitorowanie skażenia endotoksynami sterylnych rękawic nitrylowych i rękawic lateksowych do pomieszczeń czystych jest kluczowym problemem w środowiskach krytycznych, w tym w przemyśle wszczepialnych wyrobów medycznych i przemyśle farmaceutycznym.
Czym są endotoksyny bakteryjne i jakie jest ich działanie?
Co to są endotoksyny bakteryjne?
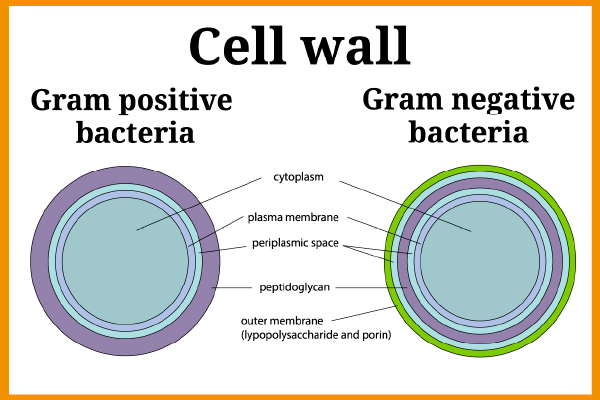
Endotoksyny lub lipopolisacharydy (LPS) to fragmenty zewnętrznej błony bakterii Gram-ujemnych (przy użyciu techniki barwienia Gram-ujemne bakterie wytwarzają różową plamę, podczas gdy w przypadku bakterii Gram-dodatnich jest ona fioletowa). Przykładami bakterii Gram-ujemnych są E. coli, Salmonella, Legionella, Neisseria itp.
Rycina 1 – Ściana komórkowa bakterii Gram-dodatnich i Gram-ujemnych
Bakterie Gram-ujemne występują wszędzie w środowisku (w wodzie, instalacjach grzewczych, przewodzie pokarmowym i kale…), dlatego obecność endotoksyn może stwarzać bardzo duże ryzyko. Cząsteczki endotoksyn uwalniane są podczas lizy (zniszczenia błony komórkowej pod wpływem czynników fizycznych, chemicznych lub biologicznych).
Jakie są konsekwencje skażenia endotoksynami?
Biologiczny skład endotoksyn wpływa na układ odpornościowy ludzi i zwierząt i może powodować reakcję alergiczną. W konsekwencji mogą prowadzić do stosunkowo silnych reakcji zapalnych. Mogą również prowadzić do poważnych infekcji u pacjentów osłabionych (z obniżoną odpornością), młodych (wcześniaków) lub starszych pacjentów.
Najczęstszą reakcją jest gorączka. Z tego powodu endotoksyny Gram-ujemne uważa się za „pirogeny” , czyli cząsteczki, które poprzez aktywację układu odpornościowego powodują wzrost temperatury ciała.
Endotoksyny wdychane mogą również powodować zespół ostrej niewydolności oddechowej (ARDS). Dostając się do organizmu po wstrzyknięciu, endotoksyny mogą powodować rozsiane wykrzepianie wewnątrznaczyniowe, a nawet wstrząs septyczny, gdy duża ich ilość przedostanie się do krwioobiegu.
W krytycznych środowiskach, takich jak przemysł farmaceutyczny, monitorowanie endotoksyn jest niezbędne. Jest to szczególnie prawdziwe w przypadku produkcji wody o jakości farmaceutycznej (wody oczyszczonej), a także produkcji leków pozajelitowych i do wstrzykiwań (płyny infuzyjne, płyny dializacyjne…) oraz wszczepialnych wyrobów medycznych.
Zmniejszanie poziomu endotoksyn w rękawicach do pomieszczeń czystych
Wiadomo, że endotoksyny są najczęstszym źródłem pirogenów w środkach farmaceutycznych i wyrobach medycznych.
Endotoksyny to pozostałości błonowe bakterii Gram-ujemnych. Te ostatnie są żywotne i liczne w środowisku. Ponadto endotoksyny są wysoce odporne na procesy dezynfekcji i sterylizacji, w tym na promieniowanie gamma.
Dlatego przed sterylizacją należy w jak największym stopniu ograniczyć obciążenie biologiczne rękawic nitrylowych i lateksowych.
Obciążenie biologiczne to koncentracja wszelkiego rodzaju żywych mikroorganizmów na powierzchni lub w urządzeniu. To obciążenie biologiczne pochodzi głównie z:
- Surowce użyte w procesie produkcyjnym (m.in. woda farmaceutyczna).
- Operatorzy zaangażowani w proces produkcyjny.
- Czyszczenie i pakowanie wytworzonych produktów.
Wykrywaniem i oznaczaniem ilościowym skażenia mikrobiologicznego sterylnych rękawiczek SHIELD Scientific zajmuje się organizacja zewnętrzna i zgodnie z normą ISO 11737-1. Jest to podstawowa część procesu kontroli jakości SHIELD Scientific .
Zatem wszystkie surowce, opakowania czy sprzęt ochronny stosowane przy produkcji farmaceutyków lub wszczepialnych wyrobów medycznych muszą spełniać wymagania zdrowotne dotyczące nie tylko sterylności, ale także pirogenności.
Sterylność: Aby zapewnić poziom zapewnienia sterylności (SAL) na poziomie 10-6 (zgodnie z wymogami Farmakopei Europejskiej), rękawice muszą zostać poddane walidacji mikrobiologicznej zgodnie z normą ISO 11137-2:2015 (Sterylizacja produktów stosowanych w ochronie zdrowia – Promieniowanie – Część 2: Ustalenie dawki sterylizującej).
Rysunek 2 – Sterylne rękawiczki SHIELDskin XTREME™ Worek PE ze wskaźnikiem sterylizacji
Apirogenność: Depirogenizację można przeprowadzić na wiele sposobów:
- Mycie wodą do wstrzykiwań (WFI) lub inną wodą wysokiej jakości, taką jak woda dejonizowana.
- Obróbka cieplna na sucho poprzez działanie wysokich temperatur.
- Wilgotna obróbka cieplna poprzez połączenie ciśnienia i nadtlenku wodoru (Uwaga: autoklaw nie niszczy endotoksyn).
- Ultrafiltracja endotoksyn według ich masy cząsteczkowej.
- Zniszczenie przez tlenek etylenu.
Dlaczego ważna jest kontrola poziomu endotoksyn w sterylnych rękawiczkach do pomieszczeń czystych?
Wymóg sterylności (brak żywych mikroorganizmów) i pirogenności (brak cząsteczek pirogennych, takich jak endotoksyny) mają ogromne znaczenie dla wielu producentów farmaceutyków i wszczepialnych wyrobów medycznych.
Aby w jak największym stopniu ograniczyć ryzyko związane z endotoksynami, należy zatem kontrolować zanieczyszczenie na wszystkich etapach procesów produkcyjnych , od surowców po gotowe produkty, łącznie ze sprzętem ochronnym operatorów pomieszczeń czystych.
Rzeczywiście dłoń w rękawiczce może mieć bezpośredni kontakt z roztworami do wstrzykiwań lub ich pojemnikami i wszczepialnymi wyrobami medycznymi. Rękawiczki są zatem potencjalnym źródłem skażenia.
Rysunek 3 – Igła maszyny napełniającej wymieniona przez operatora noszącego podwójną parę sterylnych rękawiczek SHIELD Scientific
Standardowe jednorazowe rękawiczki nitrylowe i lateksowe poddawane są minimalnej obróbce po zakończeniu etapów zanurzania i suszenia. Dlatego poziom czystości rękawic może nie być akceptowalny w zastosowaniach w pomieszczeniach czystych. Należy również pamiętać, że rękawice mogą być w dużym stopniu obciążone bakteriami Gram-ujemnymi. Nawet sterylne rękawiczki do pomieszczeń czystych, które zazwyczaj są chlorowane i prane w oczyszczonej wodzie, często nie dają gwarancji pod względem poziomu endotoksyn.
Ponadto, ponieważ cząstki mogą przenosić endotoksyny, wybór rękawic o „gwarantowanym niskim poziomie” cząstek może pomóc we wzmocnieniu strategii kontroli zanieczyszczeń.
Dlatego rozwiązaniem może być wybór rękawic o niskiej zawartości endotoksyn (<20 EU/parę zgodnie z definicją zawartą w normie EN 455-3:2015), a co jeszcze lepsze, które są testowane partiami pod kątem endotoksyn.
W jaki sposób monitoruje się poziom endotoksyn w sterylnych rękawiczkach do pomieszczeń czystych?
Ramy regulacyjne dotyczące skażenia sterylnych rękawiczek endotoksynami
Załącznik 1 do GMP Unii Europejskiej jest jednym z głównych dokumentów regulujących wytwarzanie i kontrolę produktów leczniczych. Niniejszy dokument zawiera wytyczne dotyczące Zarządzania Ryzykiem Jakości. W szczególności nowy Załącznik I do GMP określa, że należy unikać skażenia produktów końcowych mikrobiologią, cząstkami stałymi oraz endotoksynami/pirogenami. Dlatego sterylne rękawice do pomieszczeń czystych muszą zostać włączone do zarządzania ryzykiem jakości (QRM).
Norma EN 455-3:2015 (Jednorazowe rękawice medyczne – Część 3: Wymagania i badania do oceny biologicznej) nakłada na producentów sterylnych rękawiczek jednorazowego użytku obowiązek kontrolowania skażenia rękawic endotoksynami. Metody badań powinny spełniać wymagania Farmakopei Europejskiej, Monografia 2.6.14.
Krab podkowiasty do wykrywania endotoksyn
Najpowszechniej stosowaną i uznaną metodą pomiaru poziomu endotoksyn bakteryjnych na sterylnych rękawiczkach do pomieszczeń czystych jest metoda wykorzystująca lizat amebocytów Limulus (LAL).
Krab podkowiasty jest przodkiem stawonoga morskiego, którego cechą charakterystyczną jest błękitna krew (a raczej hemolimfa w przypadku bezkręgowców).
Ryc. 4 – Krab podkowiasty – Limulus polifemus
Hemolimfa ta zawiera komórki amebocytów o jajowatym kształcie, które w obecności endotoksyn tracą ten kształt i agregują w skrzep. Ta koagulacja krwi kraba podkowiastego jest podstawą różnych metod testowania oznaczania endotoksyn.
Metody badań oznaczania skażenia endotoksynami sterylnych rękawiczek
Zewnętrzną powierzchnię pary rękawiczek poddaje się najpierw ekstrakcji 40 do 50 ml wody wolnej od endotoksyn (woda LAL zgodnie z Farmakopeą Europejską) przez 40 do 60 minut w temperaturze od 37°C do 40°C Następnie ekstrakt w razie potrzeby odwirowuje się (2000 g przez 15 minut) w celu usunięcia cząstek. Następnie zlewa się go przed natychmiastowym poddaniem testowi na obecność endotoksyn.
Istnieją 3 główne metody badania endotoksyn bakteryjnych przy użyciu lizatu amebocytów Limulus:
- Test żelowo-skrzepowy (test „jakościowy” = umożliwia wykrycie obecności endotoksyn, ale bez możliwości dokładnego określenia ich ilości): tworzenie się żelu („skrzep”) po zmieszaniu ekstraktu i środka LAL.
- Test turbidymetrii kinetycznej (Test „ilościowy” = pozwala wykryć obecność endotoksyn i określić ich ilość): rozwój zmętnienia po zmieszaniu z odczynnikiem LAL.
- Test chromogenny (Test „ilościowy” = pozwala wykryć obecność endotoksyn i określić ich ilość): pojawienie się zabarwienia po zmieszaniu z odczynnikiem LAL.
Wynik testu podaje się w jednostkach endotoksyny (EU) na parę rękawiczek.
Norma EN 455-3:2015 stanowi, że aby rękawice mogły być oznaczone etykietą „niska zawartość endotoksyn”, musi mieć limit zawartości endotoksyn wynoszący 20 UE na parę rękawic.
SHIELD Scientific sterylne rękawice o niskiej zawartości endotoksyn, przeznaczone do środowisk krytycznych
Aby ograniczyć ryzyko niektórych powikłań u pacjentów, należy pamiętać o stosowaniu dobrej jakości sterylnych rękawiczek o niskiej zawartości endotoksyn.
W ramach ogólnej strategii kontroli zanieczyszczeń i zarządzania ryzykiem jakości (QRM) pomocne może być przemyślenie wyboru rękawic i jego zastosowania w krytycznym środowisku.
Właśnie dlatego SHIELD Scientific opracowało gamę rękawic nitrylowych i lateksowych do pomieszczeń czystych, które oferują różne poziomy czystości bezpośrednio powiązane z ilością mycia w wodzie dejonizowanej. W przypadku tej gamy rękawic jednorazowych istnieje prosta klasyfikacja:
DI: Rękawice prane pojedynczo w wodzie dejonizowanej w celu podstawowej kontroli zanieczyszczeń i przy specyfikacji poziomu cząstek < 3000 na cm² > 0,5 μm.
DI+ : Rękawice trzykrotnie wyprane w wodzie dejonizowanej w celu kontroli wysokiego poziomu zanieczyszczeń i wymaganego poziomu cząstek < 1200 na cm² > 0,5 μm.
DI++ : Rękawice wielokrotnie prane w wodzie dejonizowanej w celu ekstremalnej kontroli zanieczyszczeń i wymaganego poziomu cząstek < 850 na cm² > 0,5 μm.
Wszystkie sterylne rękawice marki SHIELDskin XTREME™ zostały zaprojektowane tak, aby spełniać standardy jakości wymagane przez operatorów pracujących zgodnie z GMP w celu zmniejszenia ryzyka skażenia. Wszystkie SHIELD Scientific do pomieszczeń czystych są testowane partiami w celu wykazania niskiej zawartości endotoksyn wynoszącej < 20 UE (jednostek endotoksyn) na parę rękawic oraz poziomu zapewnienia sterylności (SAL) wynoszącego 10-6 (poprzez sterylizację promieniowaniem gamma).
Do każdej partii sterylnych rękawic nitrylowych i lateksowych do pomieszczeń czystych SHIELD Scientific dołączony jest certyfikat napromieniowania. Certyfikat zgodności (CoC) zapewnia dane dotyczące poszczególnych partii dotyczące poziomu cząstek i endotoksyn.
PONIEWAŻ KONTROLA ZANIECZYSZCZEŃ ENDOTOKSYNAMI JEST WAŻNA W KRYTYCZNYCH ŚRODOWISKACH, NIE CZEKAJ DŁUŻEJ, ABY ZAMÓWIĆ PRÓBKI LUB ZADAJ PORADĘ PRZEDSTAWICIELA SPRZEDAŻY SHIELD Scientific .
Podziel się tą interesującą informacją