CONTRÔLE DE LA CONTAMINATION PAR ENDOTOXINES SUR LES GANTS STÉRILES POUR SALLES BLANCHES

Les produits pharmaceutiques injectables ou les dispositifs médicaux implantables contaminés par des endotoxines peuvent provoquer une réaction très grave chez le patient.
La contamination par endotoxines de lots de solutions injectables ou d'implants peut également avoir des conséquences financières importantes pour le fabricant.
Par conséquent, la surveillance de la contamination par les endotoxines sur les gants stériles en nitrile et les gants en latex pour salles blanches est une préoccupation majeure pour les environnements critiques, notamment l’industrie des dispositifs médicaux implantables et l’industrie pharmaceutique.
Que sont les endotoxines bactériennes et leur impact ?
Que sont les endotoxines bactériennes ?
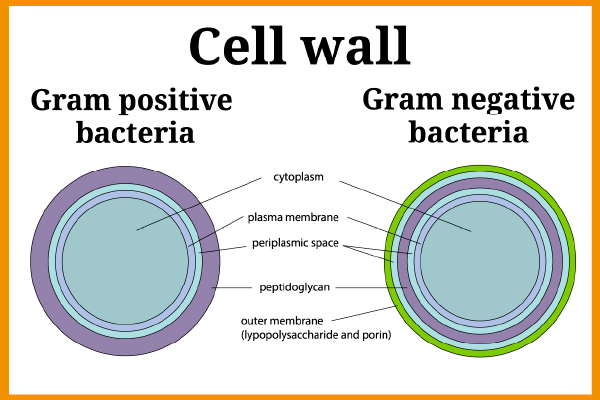
Les endotoxines ou lipopolysaccharides (LPS) sont des fragments de la membrane externe des bactéries à Gram négatif (grâce à la technique de coloration de Gram, les bactéries à Gram négatif produisent une coloration rose alors qu'elle est violette pour les bactéries à Gram positif). Quelques exemples de bactéries à Gram négatif sont E. coli, Salmonella, Legionella, Neisseria, etc.
Figure 1 – Paroi cellulaire des bactéries Gram positives et Gram négatives
Les bactéries à Gram négatif existent partout dans l'environnement (dans l'eau, les systèmes de chauffage, le tube digestif, les selles…) et la présence d'endotoxines peut donc présenter un risque très élevé. Les molécules d'endotoxines sont libérées lors de la lyse (destruction de la membrane d'une cellule sous l'action d'un agent physique, chimique ou biologique).
Quelles sont les conséquences d’une contamination par des endotoxines ?
La composition biologique des endotoxines a un impact sur le système immunitaire humain et animal et peut provoquer une réaction allergique. Par conséquent, ils peuvent entraîner des réactions inflammatoires relativement fortes. Ils peuvent également entraîner des infections graves chez les patients affaiblis (immunodéprimés), jeunes (prématurés) ou âgés.
La réaction la plus courante est la fièvre. C'est pourquoi les endotoxines à Gram négatif sont considérées comme des « pyrogènes » , c'est-à-dire des molécules qui déclenchent une élévation de la température corporelle en activant le système immunitaire.
Les endotoxines, lorsqu'elles sont inhalées, peuvent également provoquer le syndrome de détresse respiratoire aiguë (SDRA). En pénétrant dans l'organisme après une injection, les endotoxines peuvent provoquer une coagulation intravasculaire disséminée, voire un choc septique lorsqu'une grande quantité atteint la circulation sanguine.
Dans des environnements critiques comme celui de l’industrie pharmaceutique, la surveillance des endotoxines est essentielle. Cela est particulièrement vrai dans la production d’eau de qualité pharmaceutique (eau purifiée), ainsi que dans la fabrication de médicaments parentéraux et injectables (liquides de perfusion, liquides de dialyse…) et de dispositifs médicaux implantables.
Réduire les niveaux d'endotoxines sur les gants de salle blanche
Les endotoxines sont connues pour être la source la plus courante de pyrogènes dans les produits pharmaceutiques et les dispositifs médicaux.
Les endotoxines sont des résidus membranaires de bactéries à Gram négatif. Ces dernières sont viables et nombreuses dans l'environnement. De plus, les endotoxines sont très résistantes aux processus de désinfection ou de stérilisation, y compris l'irradiation gamma.
C'est pourquoi la charge biologique des gants en nitrile et en latex doit être limitée autant que possible avant la stérilisation.
La biocharge est la concentration de toutes sortes de micro-organismes viables sur une surface ou dans un appareil. Cette charge biologique provient principalement de :
- Matières premières utilisées pendant le processus de production (y compris l'eau de qualité pharmaceutique).
- Opérateurs impliqués dans le processus de fabrication.
- Opérations de nettoyage et de conditionnement de produits manufacturés.
La détection et la quantification de la contamination microbienne sur les gants stériles SHIELD Scientific sont entreprises par un organisme externe et conformément à la norme ISO 11737-1. Il s’agit d’un élément fondamental du processus de contrôle qualité de SHIELD Scientific .
Ainsi, toutes les matières premières, emballages ou équipements de protection utilisés dans la fabrication de produits pharmaceutiques ou de dispositifs médicaux implantables doivent répondre aux exigences sanitaires non seulement de stérilité mais aussi de pyrogénicité.
Stérilité : Pour garantir un niveau d'assurance de stérilité (SAL) de 10-6 (conformément aux exigences de la Pharmacopée européenne), les gants doivent subir une validation microbiologique conformément à la norme ISO 11137-2:2015 (Stérilisation des produits de santé – Rayonnement – Partie 2 : Etablissement de la dose de stérilisation).
Figure 2 – Gants stériles SHIELDskin XTREME™ sac en PE avec indicateur de stérilisation
Apyrogénicité : La dépyrogénation peut se faire de plusieurs manières :
- Lavage avec de l'eau pour préparations injectables (WFI) ou une autre eau de haute qualité telle que de l'eau déminéralisée.
- Traitement thermique sec par exposition à des températures élevées.
- Traitement thermique humide par combinaison de pression et de peroxyde d'hydrogène (Attention : un autoclave ne détruit pas les endotoxines).
- Ultra filtration des endotoxines selon leur poids moléculaire.
- Destruction par l'oxyde d'éthylène.
Pourquoi est-il important de contrôler les niveaux d’endotoxines sur les gants stériles pour salle blanche ?
L'exigence de stérilité (absence de micro-organismes vivants) et de pyrogénicité (absence de molécules pyrogènes telles que les endotoxines) sont primordiales pour de nombreux fabricants de produits pharmaceutiques et de dispositifs médicaux implantables.
Pour limiter au maximum les risques liés aux endotoxines, la contamination doit donc être contrôlée tout au long des processus de production , des matières premières aux produits finis, en passant par les équipements de protection des opérateurs des salles blanches.
En effet, la main gantée peut être en contact direct avec les solutions injectables ou leurs contenants et dispositifs médicaux implantables. Les gants sont donc potentiellement une source de contamination.
Figure 3 – Aiguille de machine de remplissage changée par un opérateur portant une double paire de gants stériles SHIELD Scientific
Les gants standards en nitrile et en latex à usage unique subissent un traitement minimal une fois les étapes de trempage et de séchage terminées. Le niveau de propreté des gants peut donc ne pas être acceptable pour les applications en salle blanche. Il convient également de noter que les gants peuvent être fortement chargés de bactéries à Gram négatif. Même les gants stériles pour salles blanches, qui sont généralement chlorés et lavés à l’eau purifiée, n’ont souvent aucune garantie en termes de niveaux d’endotoxines.
De plus, puisque les particules peuvent transmettre des endotoxines, la sélection de gants avec un « faible niveau garanti » de particules pourrait contribuer à renforcer votre stratégie de contrôle de la contamination.
Par conséquent, la sélection de gants ayant une faible allégation endotoxines (<20 UE/paire tel que défini dans la norme EN 455-3:2015) et, mieux encore, qui sont testés par lots pour les endotoxines peut être une solution.
Comment le niveau d’endotoxines des gants stériles pour salles blanches est-il surveillé ?
Cadre réglementaire lié à la contamination par endotoxines des gants stériles
L'annexe 1 des BPF de l'Union européenne est l'un des principaux documents régissant la fabrication et le contrôle des médicaments. Ce document fournit des lignes directrices pour la gestion des risques liés à la qualité. En particulier, l'annexe I des nouvelles BPF précise que la contamination microbienne, particulaire et endotoxine/pyrogène des produits finaux doit être évitée. Les gants stériles pour salle blanche doivent donc être intégrés dans la gestion des risques qualité (QRM).
La norme EN 455-3:2015 (Gants médicaux à usage unique – Partie 3 : Exigences et tests pour l'évaluation biologique) impose aux fabricants de gants stériles à usage unique de contrôler la contamination des gants par les endotoxines. Les méthodes d'essai doivent être conformes aux exigences de la Pharmacopée européenne, monographie 2.6.14.
Le limule pour détecter les endotoxines
La méthode la plus largement utilisée et reconnue pour mesurer le niveau d’endotoxines bactériennes sur les gants stériles pour salles blanches est celle utilisant le lysate d’amibocyte de Limulus (LAL).
Le limule est un arthropode marin ancestral qui a la particularité d'avoir du sang bleu (ou plutôt une hémolymphe dans le cas d'un invertébré).
Figure 4 – Limule-Limulus polyphemus
Cette hémolymphe contient des cellules amibocytaires de forme ovoïde, qui perdent cette forme et s'agrègent en caillot en présence d'endotoxines. Cette coagulation du sang du limule constitue la base des différentes méthodes de test de détermination des endotoxines.
Méthodes d'essai pour la détermination de la contamination par endotoxines des gants stériles
La surface extérieure d'une paire de gants est préalablement soumise à une extraction de 40 à 50 ml d'eau exempte d'endotoxines (eau LAL selon la Pharmacopée Européenne) pendant 40 à 60 minutes à une température comprise entre 37°C et 40°C. L'extrait est ensuite, si nécessaire, centrifugé (2 000 g pendant 15 minutes) pour éliminer les particules. Il est ensuite décanté avant d'être immédiatement soumis à un test d'endotoxines.
Il existe 3 méthodes principales de test des endotoxines bactériennes utilisant le lysat d’amibocyte de Limulus :
- Test gel-clot (Un test « qualitatif » = permet de détecter la présence d'endotoxines mais sans pouvoir en déterminer précisément la quantité) : formation d'un gel (« caillot ») après mélange de l'extrait et de l'agent LAL.
- Test de turbidimétrie cinétique (Un test « quantitatif » = permet de détecter la présence d'endotoxines et d'en déterminer la quantité) : évolution de la turbidité après mélange avec le réactif LAL.
- Test chromogénique (Un test « quantitatif » = permet de détecter la présence d'endotoxines et d'en déterminer la quantité) : évolution d'une couleur après mélange avec le réactif LAL.
Le résultat du test est rapporté en unité d'endotoxine (UE) par paire de gants.
La norme EN 455-3:2015 stipule que pour être étiquetés « faible teneur en endotoxines », les gants doivent avoir une limite de teneur en endotoxines de 20 UE par paire de gants.
Gants stériles SHIELD Scientific à faible teneur en endotoxines pour environnements critiques
Pour limiter le risque de certaines complications chez les patients, il convient de veiller à utiliser des gants stériles de bonne qualité et à faible teneur en endotoxines.
Dans le cadre d'une stratégie globale de contrôle de la contamination et de gestion des risques qualité (QRM), il peut être utile de réfléchir à la sélection des gants et à la manière dont cela s'applique à votre environnement critique.
C'est pourquoi SHIELD Scientific a développé une gamme de gants pour salle blanche en nitrile et en latex qui offrent différents niveaux de propreté directement liés à la quantité de lavage à l'eau déminéralisée. Pour cette gamme de gants à usage unique, il existe une classification simple :
DI : Gants lavés une seule fois à l'eau déminéralisée pour un contrôle de base de la contamination et une spécification de niveau de particules < 3 000 par cm² > 0,5 μm.
DI+ : Gants lavés trois fois à l'eau déminéralisée pour un contrôle élevé de la contamination et une spécification de niveau de particules < 1 200 par cm² > 0,5 μm.
DI++ : Gants multi-lavés à l'eau déminéralisée pour un contrôle extrême de la contamination et une spécification de niveau de particules < 850 par cm² > 0,5μm.
Tous les gants stériles de la marque SHIELDskin XTREME™ sont conçus pour répondre aux normes de qualité requises par les opérateurs travaillant selon les BPF afin de réduire le risque de contamination. Tous SHIELD Scientific sont testés par lots pour démontrer une faible teneur en endotoxines < 20 UE (unité d'endotoxine) par paire de gants et un niveau d'assurance de stérilité (SAL) de 10-6 (par stérilisation par irradiation gamma).
Un certificat d'irradiation (CoI) est fourni avec chaque lot de gants stériles pour salle blanche en nitrile et en latex SHIELD Scientific . Un certificat de conformité (CoC) fournit des données spécifiques au lot sur les niveaux de particules et d'endotoxines.
PARCE QUE LE CONTRÔLE DE LA CONTAMINATION PAR ENDOTOXINE EST VITAL DANS LES ENVIRONNEMENTS CRITIQUES, N'ATTENDEZ PLUS POUR COMMANDER DES ÉCHANTILLONS OU DEMANDER CONSEIL À UN REPRÉSENTANT COMMERCIAL SHIELD Scientific .
Partagez cette information intéressante